Organix Gastro, czyli pośredni test dysbiozy jelitowej, to rodzaj badania wykonywanego z moczu, którego celem jest rzekoma ocena stanu mikrobioty jelitowej. W ostatnim czasie mocno zyskuje on na popularności, toteż doszedłem do wniosku, że podzielę się swoimi spostrzeżeniami oraz obiekcjami odnośnie wartości diagnostycznej tego testu. No więc zaczynajmy 😉
Organix Gastro – na czym polega?
W ramach testu Organix Gastro pacjent oddaje próbkę moczu, która następnie jest analizowana pod kątem stężenia 12 różnych związków organicznych, będących metabolitami produkowanymi przez mikroorganizmy jelitowe. Podwyższone lub obniżone stężenia tych markerów mają wskazywać na obecność dysbiozy jelitowej i rozrost poszczególnych bakterii, drożdżaków czy nawet obecność pasożytów.
Rzeczywiście, warto zauważyć, że istnieją pewne przesłanki naukowe, że stężenia poszczególnych metabolitów mogą ulegać zmianom pod wpływem stosowanej diety, obecnych chorób czy generalnie dysbiozy jelitowej (w tym SIBO) [1].
Chociaż bez wątpienia stan jelit wywiera istotny wpływ na stężenie wspomnianych metabolitów w moczu to tutaj pojawia się pierwszy problem – dieta stanowi istotny czynnik zaburzający i w wielu przypadkach to od składu diety i posiłków spożytych przed badaniem będzie zależeć stężenie i równowaga poszczególnych metabolitów – a więc również końcowy wynik badania.
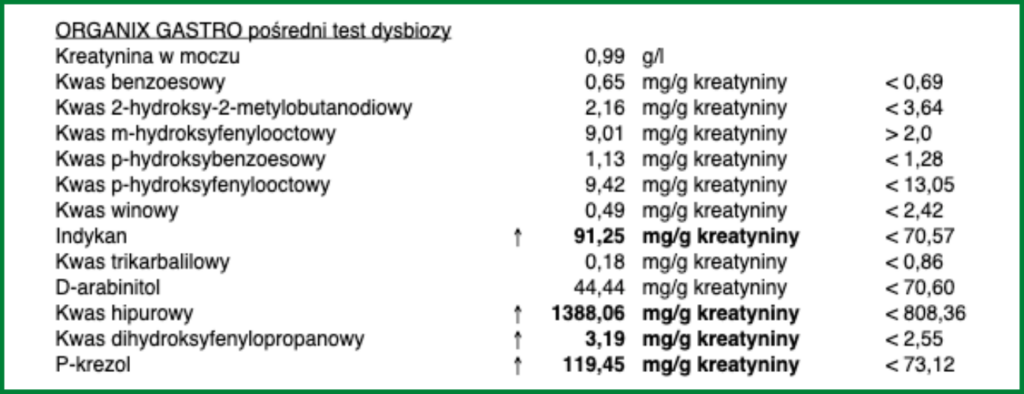
Organix Gastro – omówienie poszczególnych metabolitów
Wynik testu Organix Gastro zawiera 12 różnych metabolitów, a więc aby móc rozmawiać o przydatności tego badania należałoby przeanalizować każdy z tych wskaźników osobno. Postaram się w tym momencie możliwie krótko i w przejrzysty sposób je Wam przedstawić.
Kwas benzoesowy
podwyższony poziom wskazuje na brak witamin B6 i glicyny w organizmie
(według wydruku z laboratorium)
Patrząc krytycznie:
- kwas benzoesowy jest powszechnie stosowany jako środek konserwujący, naturalnie występuje w owocach jagodowych, a dodatkowo powstaje w wyniku fermentacji bakteryjnej fenyloalaniny i polifenoli (a więc spożywanie różnych zdrowych produktów może zwiększać stężenia kwasu benzoesowego w moczu),
- kwas benzoesowy jest sprzęgany z glicyną, a więc ograniczenie dostępności glicyny może prowadzić do wysokiego poziomu kwasu benzoesowego,
- nie ma danych, aby witamina B6 była jakkolwiek zaangażowana w metabolizm kwasu benzoesowego (natomiast witamina B5 potencjalnie tak) [2].
Podsumowując: stężenie markera może w dużym stopniu zależeć od składu diety oraz statusu glicyny, natomiast nie zależy od wysycenia witaminą B6, nie ma ustalonych norm referencyjnych (bardzo duże różnice w różnych publikacjach naukowych) – marker mało przydatny.
Kwas winowy
podwyższony poziom wskazuje na wzmożony przyrost grzybów w jelicie
(według wydruku z laboratorium)
Patrząc krytycznie:
- poziom kwasu winowego w moczu istotnie koreluje ze spożyciem winogron, wina, rodzynek [3], zaś w badaniu na szczurach stężenia kwasu winowego ulegało 8-krotnemu wzrostowi pod wpływem zwiększonej podaży skrobi opornej (korzystny składnik diety) [4],
- nie ma dowodów, aby jakikolwiek rodzaj grzybów lub drożdżaków w jelitach mógł wytwarzać kwas winowy (więc nie można tego wykorzystywać jako marker rozrostu drożdżaków),
- prędzej kwas winowy może stanowić pożywkę do wzrostu grzybów, natomiast dotyczy to głównie grzybów podstawkowych (np. takich rosnących w lesie), a większość popularnych drożdżaków tj. Candida czy Saccharomyces nie potrafi w ogóle rozkładać kwasu winowego [5].
Podsumowując: składniki diety silnie wpływają na stężenia kwasu winowego w moczu, a jego produkcja przez drożdżaki jest nieistotna, brak rzetelnych norm referencyjnych – marker całkowicie nieprzydatny.
D-arabinitol
kolonizacja szczepami Candida spp.
(według wydruku z laboratorium)
Patrząc krytycznie:
- d-arabinitol jest metabolitem produkowanym przez większość patogennych gatunków Candida i zwiększone jego stężenia w moczu oraz krwi korelują z rozrostem Candida oraz inwazyjną kandydozą [6],
- zaznaczam, że dowody dotyczą zwłaszcza inwazyjnej kandydozy (którą leczy się zazwyczaj w szpitalach), natomiast nie jest jasne czy d-arabinitol może być przydatnym wskaźnikiem do diagnozowania rozrostu Candida w jelitach (np. SIFO),
- niemal wszystkie badania do tej pory opierały się na oznaczaniu stosunku d-arabinitolu do l-arabinitolu w surowicy (na ten moment nie są znane optymalne wartości odcięcia dla stosunku d-arabinitolu do kreatyniny w moczu – czyli wskaźnika stosowanego w teście Organix Gastro).
Podsumowując: d-arabinitol w moczu może być dość przydatnym wskaźnikiem w diagnostyce inwazyjnej kandydozy, ale wciąż nie ustalono jednoznacznych punktów odcięcia (z pewnym kredytem zaufania można polegać na normach wypracowanych przez laboratoria) – marker obiecujący.
Indykan
produkt nadmiernego przyrostu masy bakterii w jelicie cienkim; zwiększone wydalanie obserwuje się m.in. w przypadku schorzeń jelita cienkiego oraz po operacjach chirurgicznych w obrębie jelita cienkiego
(według wydruku z laboratorium)
Patrząc krytycznie:
- większość indykanu w moczu pochodzi z rozkładu tryptofanu w wyniku działania mikroorganizmów bytujących w jelitach,
- podwyższony poziom indykanu w moczu może wskazywać na rozrost bakterii w jelicie cienkim (SIBO) – szacowana czułość nawet 80-90%, ale badania są sprzeczne (w jednej z publikacji nie wykazano istotnego związku z SIBO) [7],
- niemniej, sugeruje się, że poziom indykanu w moczu może odzwierciedlać aktywność i liczebność Escherichia coli w jelicie cienkim (jedna z głównych bakterii związanych z obecnością SIBO) [8],
- największe wątpliwości dotyczą powtarzalności i optymalnych wartości referencyjnych (nie zostały do tej pory ustalone).
Podsumowując: indykan w moczu wygląda na całkiem atrakcyjny wskaźnik, ale są niezbędne lepsze jakościowo badania aby to potwierdzić – marker obiecujący

p-Krezol
powstaje wskutek obecności bakterii tj. Proteus vulgaris, Clostridium difficile oraz pierwotniaków Giardia lamblia
(według wydruku z laboratorium)
Patrząc krytycznie:
- p-krezol jest produkowany w wyniku bakteryjnej fermentacji białka/aminokwasów aromatycznych przez bakterie w jelicie grubym (jest to naturalny proces),
- im wyższe spożycie białka, tym większe stężenia p-krezolu w moczu, natomiast dieta niskobiałkowa zmniejsza stężenia p-krezolu [9],
- stężenie p-krezolu koreluje z rozrostem Clostridium i niektórych innych bakterii gnilnych, rozpatruje się jako jeden ze wskaźników dysbiozy jelitowej,
- podwyższone stężenia obserwuje się u pacjentów z cukrzycą, przewlekłą chorobą nerek, chorobą Parkinsona, autyzmem, wolniejszym pasażem jelitowym i wielu innych przypadkach (brak specyficzności) [10],
- brak ustalonych norm referencyjnych i bardzo duże różnice w stężeniach p-krezolu nawet u osób zdrowych (!).
Podsumowując: wzrost stężenia p-krezolu może wynikać z różnych czynników i występuje duża zmienność międzyosobnicza, podwyższony poziom nie jest specyficzny dla któregokolwiek z zaburzeń – marker o wątpliwej wartości diagnostycznej
Kwas p-hydroksyfenylooctowy
nadmierne zasiedlenie jelita cienkiego przez Giardia lamblia lub niektóre bakterie beztlenowe
(według wydruku z laboratorium)
Patrząc krytycznie:
- kwas p-hydroksyfenylooctowy występuje powszechnie w żywności (oliwki, kakao, owies, grzyby) – a więc dieta może wpływać na jego stężenia w moczu,
- podwyższony pozom może wskazywać na chorobę jelita cienkiego (w tym resekcję jelita, infekcję Giardia lamblia czy SIBO) – nie jest natomiast specyficzny dla żadnej z tych chorób [11],
- powyższe badanie przeprowadzono na niemowlętach i małych dzieciach, brak innych badań do porównania (np. jak sytuacja wygląda u osób dorosłych) – stężenia tego kwasu są znacznie wyższe u dzieci niż dorosłych,
- nie znamy optymalnych wartości referencyjnych.
Podsumowując: wstępne przesłanki, że stężenie kwasu p-hydroksyfenylooctowego może wskazywać na różne choroby jelita cienkiego u dzieci (brak danych u dorosłych) – marker o niskiej do umiarkowanej wartości diagnostycznej
Kwas p-hydroksybenzoesowy
wskaźnik wzmożonej obecności bakterii E.coli
(według wydruku z laboratorium)
Patrząc krytycznie:
- kwas powszechnie występujący w żywności (kokos, migdały, jagody, wino, wanilia, zielona herbata),
- wykazuje korzyści zdrowotne (działanie przeciwnowotworowe, neuroprotekcyjne, kardioprotekcyjne, jest prekursorem koenzymu Q10),
- sprzyja rozwojowi pożytecznych mikroorganizmów w jelitach (np. Lactobacillus, Bifidobacterium), zmniejsza liczebność patogenów (np. Clostridium),
- stężenie kwasu p-hydroksybenzoesowego wzrosło prawie 3-krotnie w czasie stosowania diety organicznej (zdrowszej, bogatej w polifenole) [12],
- rozrost Escherichia coli koreluje ze wzrostem stężenia tego metabolitu (kiedy wysoki poziom jest dobry, a kiedy zły?) [13],
Podsumowując: marker wiąże się z lepszymi wskaźnikami zdrowotnymi i mniej przetworzoną dietą, w pewnych okolicznościach może odzwierciedlać rozrost Escherichia coli, ale ciężko określić nieprawidłową wartość – marker mało przydatny
Pozostałe metabolity
Poniższą piątkę opisałem bardzo skrótowo szanując Wasz i mój czas, zwyczajnie ich zastosowanie w diagnostyce na ten moment jest bardzo wątpliwe i słabo opisane w literaturze naukowej:
- kwas 2-hydroksy-2-metylobutanodiowy – znikoma ilość informacji w literaturze naukowej, ciężko określić przydatność diagnostyczną,
- kwas m-hydroksyfenylooctowy – wyższe poziomy korelują z liczebnością Clostridium, niewielka ilość danych w literaturze naukowej,
- kwas trikarbalilowy – bardzo duża zmienność u ludzi, marker użyteczny co najwyżej w badaniach epidemiologicznych [14],
- kwas hipurowy – jest metabolitem kwasu benzoesowego (omówiony wyżej), brak opisanego związku z patologiami jelitowymi, a wręcz może wykazywać działanie korzystne [15],
- kwas dihydroksyfenylopropanowy – jest biomarkerem spożycia produktów pełnoziarnistych, brak opisanego związku z patologiami jelitowymi [16],
Organix Gastro – dlaczego nie polecam?
Na podstawie powyższego opisu można jasno wywnioskować dlaczego nie jestem fanem testu Organix Gastro i nie uważam go za wartościowy test diagnostyczny.
Pierwsza rzecz – w przypadku żadnego z metabolitów do tej pory nie określono rzetelnych norm referencyjnych i są one obecnie ustalane na podstawie danych wewnętrznych przez laboratoria diagnostyczne (jak słusznie zauważył autor bloga Pacjenci we Mgle, zakres norm dla niektórych metabolitów potrafił zmienić się nawet 20-30 krotnie na przestrzeni lat!).
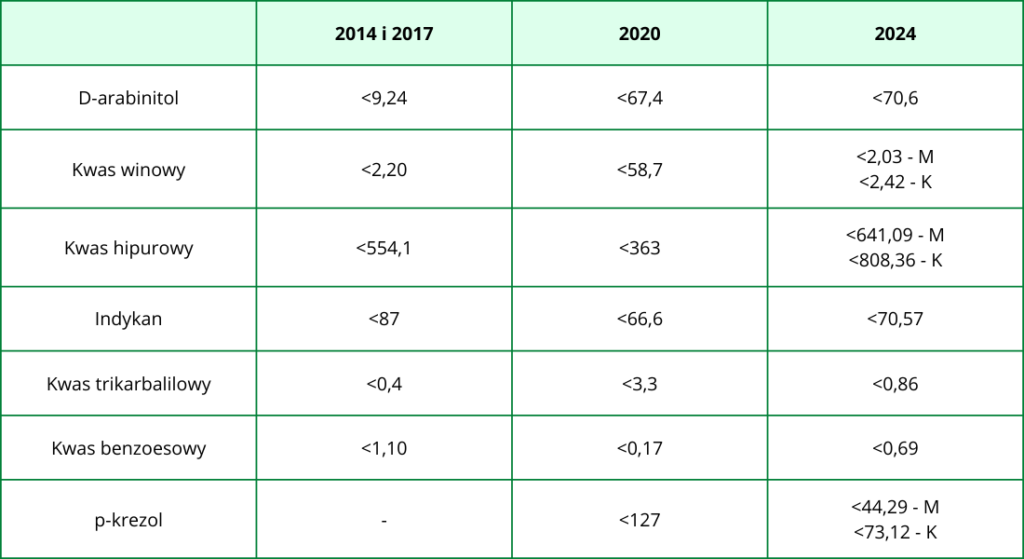
Druga rzecz – wskazówki dotyczące interpretacji wyników testu sugerują, że nieprawidłowy wynik zawsze jest zjawiskiem patologicznym, najczęściej wynikającym z obecnej dysbiozy jelitowej, podczas gdy w wielu przypadkach podwyższone wartości poszczególnych metabolitów mogą być np. efektem stosowanej diety.
Trzecia rzecz – wskazówki zamieszczane na wydrukach wyników zawierają rażące błędy (kwas winowy nie ma związku z rozrostem grzybów w jelicie, witamina B5 a nie B6 jest zaangażowana w metabolizm kwasu benzoesowego itp.).
Warto tutaj dodać, że metabolity analizowane w trakcie testu Organix Gastro nigdy nie zostały poddane rzetelnej walidacji w diagnostyce jakichkolwiek chorób czy zaburzeń, a więc ich realna użyteczność jest nieznana i pojawia się tutaj spore pole do nadużyć – zwłaszcza jeżeli chodzi o normy referencyjne poszczególnych metabolitów.
Podsumowanie
Test Organix Gastro analizuje 2 potencjalnie wartościowe metabolity, które w przyszłości mogą znaleźć swoje ograniczone zastosowanie w diagnostyce, natomiast większość analizowanych parametrów nie ma żadnej wartości diagnostycznej i może istotnie wprowadzać pacjentów w błąd.
Można powiedzieć, że test ten „coś” wykrywa, natomiast nie da się powiedzieć co dokładnie, a już na pewno nie da się na jego podstawie zdiagnozować jakiegokolwiek schorzenia czy dostosować suplementacji w celu korekcji dysbiozy jelitowej – stąd ja osobiście odradzam biorąc pod uwagę ograniczoną użyteczność oraz spore koszty takiego badania.
- Lee YT, Huang SQ, Lin CH, Pao LH, Chiu CH. Quantification of Gut Microbiota Dysbiosis-Related Organic Acids in Human Urine Using LC-MS/MS. Molecules. 2022;27(17):5363. PubMed
- Palekar A. Effect of pantothenic acid on hippurate formation in sodium benzoate-treated HepG2 cells. Pediatr Res. 2000;48(3):357-359. PubMed
- Regueiro J, Vallverdú-Queralt A, Simal-Gándara J, Estruch R, Lamuela-Raventós RM. Urinary tartaric acid as a potential biomarker for the dietary assessment of moderate wine consumption: a randomised controlled trial. Br J Nutr. 2014;111(9):1680-1685. PubMed
- Kieffer DA, Piccolo BD, Vaziri ND, et al. Resistant starch alters gut microbiome and metabolomic profiles concurrent with amelioration of chronic kidney disease in rats. Am J Physiol Renal Physiol. 2016;310(9):F857-F871. PubMed
- Fonseca A. Utilization of tartaric acid and related compounds by yeasts: taxonomic implications. Can J Microbiol. 1992;38(12):1242-1251. PubMed
- Gold JW, Wong B, Bernard EM, Kiehn TE, Armstrong D. Serum arabinitol concentrations and arabinitol/creatinine ratios in invasive candidiasis. J Infect Dis. 1983;147(3):504-513. PubMed
- Khoshini R, Dai SC, Lezcano S, Pimentel M. A systematic review of diagnostic tests for small intestinal bacterial overgrowth. Dig Dis Sci. 2008;53(6):1443-1454. PubMed
- Tabaqchali S, Okubadejo OA, Neale G, Booth CC. Influence of abnormal bacterial flora on small intestinal function. Proc R Soc Med. 1966;59(12):1244-1246. PubMed
- Geypens B, Claus D, Evenepoel P, et al. Influence of dietary protein supplements on the formation of bacterial metabolites in the colon. Gut. 1997;41(1):70-76. PubMed
- Toft PB, Vanslette AM, Trošt K, et al. Microbial metabolite p-cresol inhibits gut hormone expression and regulates small intestinal transit in mice. Front Endocrinol (Lausanne). 2023;14:1200391. PubMed
- Chalmers RA, Valman HB, Liberman MM. Measurement of 4-hydroxyphenylacetic aciduria as a screening test for small-bowel disease. Clin Chem. 1979;25(10):1791-1794. PubMed
- Hurtado-Barroso S, Quifer-Rada P, Marhuenda-Muñoz M, et al. Increase of 4-Hydroxybenzoic, a Bioactive Phenolic Compound, after an Organic Intervention Diet. Antioxidants (Basel). 2019;8(9):340. PubMed
- Sorokina E, Pautova A, Fatuev O, et al. Promising Markers of Inflammatory and Gut Dysbiosis in Patients with Post-COVID-19 Syndrome. J Pers Med. 2023;13(6):971. PubMed
- Riley RT, Torres O, Showker JL, et al. The kinetics of urinary fumonisin B1 excretion in humans consuming maize-based diets. Mol Nutr Food Res. 2012;56(9):1445-1455. PubMed
- Yang Y, Huang S, Liao Y, et al. Hippuric acid alleviates dextran sulfate sodium-induced colitis via suppressing inflammatory activity and modulating gut microbiota. Biochem Biophys Res Commun. 2024;710:149879. PubMed
- Guyman LA, Adlercreutz H, Koskela A, Li L, Beresford SA, Lampe JW. Urinary 3-(3,5-dihydroxyphenyl)-1-propanoic acid, an alkylresorcinol metabolite, is a potential biomarker of whole-grain intake in a U.S. population. J Nutr. 2008;138(10):1957-1962. PubMed
Masz problemy jelitowe i potrzebujesz konsultacji dietetycznej?
Wypełnij formularz współpracy, a z pewnością odezwę się do Ciebie!











Nie do końca zrozumiałam. Czy da się wyczytać z tych wyników czy jest SIBO? Dziecko, 4 lata, które nie wykona testu wydechowego na potwierdzenie, a z Organix 'wyszło’ SIBO.
Na podstawie obecnych wytycznych taki test nie jest zaakceptowany do wykrywania SIBO, stanowi co najwyżej „ciekawostkę”.
Dzięki za artykuł! Rozumiem, że uważa Pan, że wdrożenie zalecanej diety przed badaniem nie ma praktycznego znaczenia dla wiarygodności wyników?
Tak, oczywiście do pewnego stopnia wpłynie na pomiar niektórych markerów, ale nadal nie uczyni to z niego miarodajnego badania.